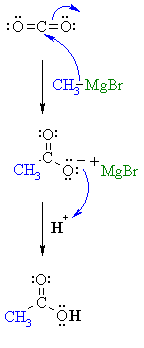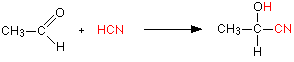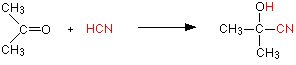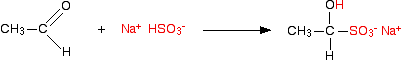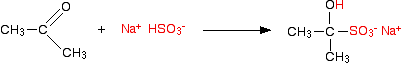الكحولات مركبات عضويه تحتوى على محموعه الهيدروكسيل ( OH ) او اكثر ،
وتحمل الكحولات الصيغه العامة ROH .
تصنف الكحولات على حسب عدد مجموعات الهيدروكسيل الى اربعه اقسام
كحولات احاديه الهيدروكسيل ( ككحول الميثيل)
كحولات ثنائيه الهيدروكسيل (مثل الجلايكول (HO-CH2-CH2-OH
كحولات ثلاثيه الهيدروكسيل (مثل الجلسرول HO-CH2-CHOH-CH2 –OH)
كحولات عديده الهيدروكسيل (مثل السوربيتول )
وايضا تصنف الكحولات احاديه الهيدروكسيل حسب عدد مجموعات الالكيل المرتبطه بذره الكربون المتصلة بمحموعه الهيدروكسيل الى
كحولات اوليه كالميتانول و الايثانول
كحولات ثانوية ك2بروبانون
كحولاث ثالتيه 2 ميثيل 2 بروبانون
التسميه : تسما مشتقات المركبات الهيدروكربونيه حسب نظامين
النظام الشائع : كحول + شق الالكيل ككحول البروبيل,
كحول الاليل ,
كحول البنزيل
الايوباك : الالكان + و ل كالبربانون ,
2 بروبينول ,
فينيل ميثانول
التحضير :
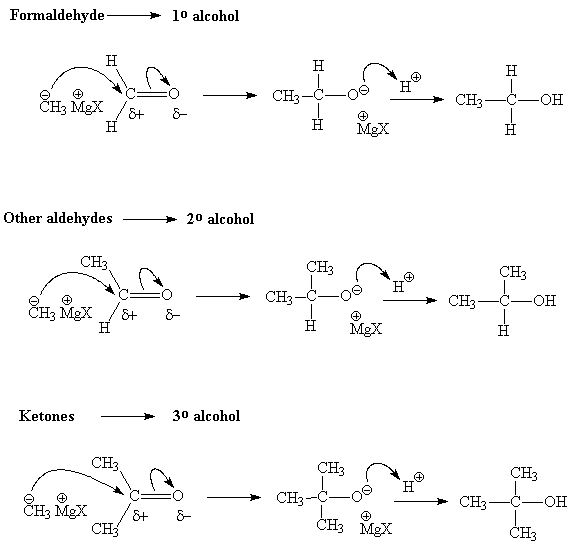
هنالك صرق عديده لتحضير الكحولات و اروع منها كيفية جرينارد لتحضير الكحولات الاوليه و الثانوية و الثالثية
لتحضير الكحولات الاوليه و هذا بتفاعل ركب جرينارد مع الفورمالدهيد
ولتحضير الكحولات الثانوبه بتفاعل مركب جرينارد مع الالدهيد
اما الكحولات الثالثيه فتحضر باضافه مركب جرينارد الى الكيتون
الخواص الفيزيائيه :
مركبات قطبيه تمتاز بخاصيه تكوين الرابطه الهيدروجينيه بين جزيئاتها حيث انها تحتوى على مجموعة الهيدروكسيل التي تعمل على تزايد التماسك بين الرابطة
تمتاز بدرجه غليان و كثافه مرتفعة
تذوب فالمذيبات القطبيه كالماء حيث انها تكون مع الماء روابط هيدروجينية
و تتميز ايضا بانه كلما زادت كتلتها الجزبئيه تقل درجه ذوبانة فالماء و تزداد درجه غليانة و انصهاره و كثافته
الخواص الكيميائيه :
تتفاعل الكحولات مع الفلزات النشطه كالصوديوم مع انها ليست احماض و هذا لان مجموعة الهيدروكسيل غير متاينه فيقوم الفلز النشط كونة عامل مختزل قوي باختزال الهيدروجين فمجموعة الهيدروكسيل كما يلى :
2CH3-OH+2Na———————–>2CH3-ONa+H2
و الناتج يسما الكوكسيد الفلز
تتفاعل الكحولات ايضا مع الاحماض و ينتج الاستر و الماء و هذي هي الكيفية الشائعه لتحضير الاسترات العضويه و غير العضويه كما ياتي:
CH3-OH+HCOOH========== HCOOCH3+H2O
الاكسده :
تتاكسد الكحولات الاوليه مكونه الالدهيد فالمرحلة الاولي بعدها يتكون الكيتون فالمرحلة الاخرى اي انها تتاكسد على مرحاتين كما ياتي:
CH3CH2OH+(O)————–>CH3CHO+H2O
CH3CHO+(O)———–>CH3COOH
اما الكحولات الثانوية تتاكسد على مرحلة واحده مكونه الكيتون
CH3-CHOH-CH3+(O)——————->CH3-CO-CH3+H2O
اما الكحولات الثالثيه فهي لا تتاكسد لعدم اتصال ذره الكربون المرتبطه بالمجموعة الفعاله بذره هيدروجين
تفاعل الهالو فورم
يختص ذلك التفاعل بالكحولاتالتى تحتوى على مجموعة الميثيل كربونيل
CH3 CH2OH +I2————–>CH3CHO + 2HI
CH3CHO+3I2———–>CI3CHO+3HI
CI3CHO+NaOH————>HCI3+HCOONa
تفاعلات الحذف(تكوين الالكين)
و ينتج عنها حذف جريء الماء من الكحول و يتم هذا باضافه حمض الكبريتيك عند درجه حراره معينة
CH3CH2OH——-H2SO4—-180C—->CH2=CH2+H2O
الاحماض الكربوكسيلية
مركبات عضويه (و تعتبر من اهم المركبات العضوية) تتميز بمجموعتها الفعاله الكربوكسيل-COOH و لها الصيغه العامة RCOOH و ممكن تصنيفها الى احماض كربوكسيليه اليفاتيه (مجموعة الكربوكسيل تكون مرتبطه بشق الكيل ) و احماض كربوكسيليه اروماتيه (مجموعة الكربوكسيل تكون مرتبطه بشكل مباشر بحلقه اروماتيه كحمض البنزويك) .
ايضا ممكن تصنيفها الى
احماض احاديه الكربوكسل كحمض الاسيتيك CH3COOH
احماض ثنائيه الكربوكسيل كHOOC-COOH حمض الاكساليك
HOOC-CH2-CH2-COOH حمض السالسليك
HOOC-CH2-COOH حمض المالنويك
احماض عديده الكربوكسيل كحمض الستريك
التسمية:
تسما الاحماض الكربوكسيليه حسب النظام الشائع كما ياتى :
حمض + المصدر الذي استخلصت منه +يك
HCOOH حمض الفورميك
CH3COOH حمض الاسيتيك
CH3 (CH2) 2COOH حمض البيوتريك
CH3 (CH2) 14COOH حمض البالميتيك
C6H5COOH حمض البنزويك
نظام الايوباك : اسم الالكان+ويك
الايثانويك و البربانويك ……….و هكذا
التحضير:
يمكن تحضير الاحماض الكربوكسيليه بهاتين الطريقتين :
باكسده الالدهيدات
CH3CHO+[O]—————–>CH3COOH
باضافه مركب جرينارد الى غاز ثاني اكسيد الكربون
الخواص الفيزيائيه :
تتميز الاحماض الكربوكسيليه بخاصيه وجود الرابطه الهيدروجينيه كما فالكحولات مما يرفع من درجه الغليان بالنسبة للمركبات الثانية المطابقة
و ايضا وجود ظاهره التجمع الجزيئى بين جميع جزيئين من جزيئاتها بسبب وجود الرابطه الهيدروجينيه الانفه الذكر
و هي تذوب بالماء و بالاخص التي تحتوى منها على سلاسل الكانيه قصيرة اما الاحماض الاروماتيه فهي لا تذوب بالماء
الخواص الكيميائيه :
تسلك الاحماض العضويه سلوك الاحماض المعدنيه فمعظم تفاعلاتها كما ياتي
CH3COOH+NaOH———————–>CH3COONa+H2O
CH3COOH+NaHCO3—————>CH3COONa+CO2+H2O
CH3COOH+NH3————–> CH3COONH4
CH3COOH+CaO———–> (CH3COO) 2Ca +H2O2
2CH3COOH+Zn——————->(CH3COO) 2Zn +H2
كما تتفاعل الاحماض مع الكحولات مكونه الاسترات العضويه :
CH3COOH+CH3OH————->CH3COOCH3+H2O
و تتفاعل مع الامينات مكونه الاميدات
CH3COOH+CH3NH2———->CH3CONHCH3+H2O
الاختزال
يختزل الحمض الكربوكسيلى كما ياتى :
CH3COOH+[H]—-Ni——–>CH3CHO+H2O
CH3COOH+ 2[H]——LiAlH4——->CH3CH2OH +H2O
هي مركبات عضويه لها الصيغه R-O-R` حيث ان R و R` تعبران عن مجموعتى الكيل او مجموعتى اريل او مجموعة الكيليه و ثانية اريليه و تصنف الايثرات الى قسمين:
ايثرات متماثله (متناظرة) حيث تكون المجموعة R مماثله للمجموعةR` كCH3OCH3 و ايثرات غير متماثله (غير متناظرة) و تنشا عندما تكون كلا المجموعتين مختلفتين كCH3OCH2CH3 .
التسميه :
لتسميه الايثرات بالكيفية الشائعه نذكر اسم شقى الالكيل او الاريل المتصلين بذره الاكسجين حسب ترتيبهما الابجدى بعدها تضاف كلمه ايثر
شقى الالكيل او الاريل + ايثر مثل
CH3OCH3 تنائى ايثيل ايثر ,
CH3CH2OCH2CH2CH3 ايثيل بروبيل ايثر
و لتسميه الايثرات حسب نظام الايوباك نعتبر -OR مجموعة بديله (فرع من المركب) تاخذ لفظ الكوكسي
التحضير :
يمكن تحضير الايثر باحدي هاتين الطريقتين :
نزع الماء من الكحول و هذا بتفاعل جزيئين من الكحول مع بعضهما فو جود حمض الكبريتيك و تستعمل هذي الكيفية لتحضير الايثرات المتماثله :
2CH3CH2OH——-H2SO4———140C—–>CH3CH2OCH2CH3+H2O
كيفية و ليامسون لتحضير الايثرات المتماثله و غير المتماثله و هذا باضافه الكوكسيد او فينوكسيد الصوديوم الى هاليد الالكيل كما ياتى :
CH3CH2ONa +CH3Cl———->NaCl+CH3CH2OCH3
الخواص الفيزيائيه :
درجه غليان الايثر منخفضه جدا جدا لعدم وجود الرابطه الهيدروجينيه بين جزيئاتها مقارنة بالكحولات و هي مركبات ذات قطبيه ضعيفه و تذوب بالمركبات القطبيه كالماء بسبب تشكل روابط هيدروجينيه بين ذرات الاكسجين فالايرات و ذرات الهيدروجين فالماء و يقل معدل الذوبانيه بزياده عدد ذرات الكربون .
الخواص الكيميائية
:كما نعلم فالايثرات لها نشاط كيميائى ضعيف اذ انها لا تتفاعل مع اي من القواعد و العوامل المؤكسده و المختزله و لا مع المعادن النشطه و لكنها تتفاعل مع الاحماض القوبيه كحمض يوديد الهيدروجين و حمض كلوريد الهيدروجين و حمض بروميد الهيدروجين عند درجاات حراره عاليه كما ياتى :
CH3O/CH3+HI ——————–>CH3ICH3OH
اما اذا كان الايثر غير متناطر فيحدث التفكك من جهه شق الالكيل الذي يحمل ذرات كربون اقل كما ياتي
CH3CH2O/CH3+HI——————->CH3CH2OH+CH3I
C6H5O/CH3+HI————->CH3I+C6H5OH
اما اذا كان هنالك جزيئين من يوديد الهيدروجين فينتج الماء و هاليد الالكيل فقط
CH3OCH3+2HI————–>H2O +2CH3I
الالدهيدات و الكيتونات
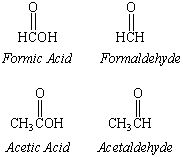
الالدهيدات و الكيتونات مشتقين من مشتقات المركبات الهيدروكربونيه يتميزان بنفس المجموعة الفعاله و هي الكربونيل C=O و للتميز بينهما تتصل مجموعة الكربونيل برابطتين فالالدهيدات احداهما تتصل بذره هيدروجين و الثانية اما بذره هيدروجين( فالفورمالدهيد ) او بذره كربون،
اما الكيتونات فتتصل مجموعة الكربونيل بذرتى كربوون
يرمز للالدهيدات بالصيغه العامة حيث تعبر R عن ذره هيدروجين او مجموعة اليفاتيه او اروماتيه .
اما الكيتونات فيرمز لها بالصيغه حيث تعبر R عن مجموعة اليفاتيه او اروماتية
التسميه :
لتسميه الالدهيدات بالكيفية الشائعه يشتق اسم الالدهيد من اسم الحمض المطابق .
اما نظام الايوباك فنذكر اسم الالكان و نضيف الية المقطع (ال) و يبدا الترقيم ابتداء من المجموعة الالدهيدية
اما الكيتونات فتسما شائعا حيث نذكر اسم المجموعتين المرتبطتين بالكربون حسب الترتيب الابجدى و نختم بكلمه كيتون
وفى نظام الايوباك نكتب اسم الالكان و نضيف الية المقطع (ون) و يبدا الترقيم من الطرف الاقرب لمجموعة الكربونيل
التحضير :
الالدهيدات :
ممكن تحضير الالدهيدات بعده طرق اهمها
اكسده الكحولات الاوليه :
الاكسده الحفزيه :
CH3CH2OH——–Cu—200C-300C——->CH3CHOH+H2
الكيتونات:
اكسده الكحولات الثانوية:
الاكسده الحفزيه :
CH3CHOHCH3——–Cu—200C-300C——->CH3COCH3+H2
الانحلال الحرارى لملح الكالسيوم العضوي:
CH3COO)2Ca——————->CH3COCH3+CaCO3)
الخواص الفيزيائيه :
نظرا لكون الاكسجين اعلي كهربيه سالبيه من الكربون يحمل الاكسجين شحنه جزيئيه سالبه و يحمل الكربون شحنه موجبه فمجموعة الكربونيل مما يجعل قوي التجاذب بين جزيئات الالدهيد و قوي التجاذب بين جزيئات الكيتون عاليه مما يؤدى الى رفع درجه غليانهما مقارنة بالهيدروكربونات المطابقه .
و تعتبر درجه غليان الالدهيدات و الكيتونات اقل من درجه غليان الكحولات المطابقه لعدم قدرتها على تكوين الرابطه الهيدروجينية
تذوب الالهيدات و الكيتونات بالماء لنشوء رابطه هيدروجينيه بين ذره الهيدروجين فالماء و ذره الاكسجين فمجموعة الكربونيل .
الخواص الكيميائيه :
الالدهيدات :
الاختزال :يختزل الالدهيد الى كيتون كما ياتى :
CH3CHO+[H]————–Ni ————>CH3CH2OH
الاكسده : اكسده الالدهيدات تعطى احماض كا ياتى :
C6H5CHO+[O]———————>C6H5COOH
الكيتونات :
الاختزال :يختزل الكيتون الى كحول ثانوي كما ياتى :
CH3COCH3+[H]——————>CH3CHOHCH3
الاكسده : لا تتاكسد الكيتونات تحت الظروف نفسها التي تتاكسد فيها الالدهيدات اذ انها تحتاج الى عوامل موكسده قويه كبرمنجنات البوتاسيوم كما ياتى :
CH3COCH3+[O]———–KMnO4———–>CH3COOH+HCOOH
ويصبح الناتج مختلفا اذاكان الكيتون يحتوى على تفرعات :
CH3)2CH-CO-CH(CH3)2+[O]————KMnO4——>(CH3)2CHCOOH+CH3COCH3
تفاعلات الاضافه :
يتشابه الالدهيد و الكيتون فتفاعلات الاضافه و هذا لاحتوئهما على مجموعة الكربونيل المستقطبه جزيئيا كما ياتي:
اضافه سانيد الهيدروجين:
اضافه NaHSO3 :
اضافه الكحول:
- ورقة عمل مشتقات المركبات الهيدروكربونية ومشتقاتها
- أسئلة في مركبات الكربونيل
- اسئلة احماض ثنائية الكربوكسيل
- حمض البربانويك
- درجات غليان مشتقات المركبات الهيدروكربونيه
- لأحماض عضوية عديدة الكربوكسيل
- مشتقات المركبات الهيدروكربونية وتفاعلاتها
- ورقة عمل لتسميه في النظام الايوباك الكربونيل
- ورقة عمل مشتقات المركبات الهيدروكربونية